ما هي النشادر؟ وما هي استخدامات غاز الأمونيا؟

الأمونيا أو النشادر؛ أحد الغازات ذات الانتشار الكبير، ورغم أنه يتمتع بخصائص عديدة خطيرة إلا أن له استخدامات مفيدة عديدة أيضاً.
يعد الأمونيا من الغازات القلوية والذي كان له استعمالات عديدة فيما مضى معظمها تم الاستغناء عنها بسبب خطورة الأمونيا على صحة الإنسان، ومع ذلك فالأمونيا لايزال يستخدم في عدد كبير من الصناعات، في هذا المقال سنتعرف على الأمونيا وأهم استخداماته.

النشادر أو الأمونيا غاز بلا لون برائحة نفاذة
الأمونيا، أو الأمونياك، أو بالعربية غاز النشادر؛ غاز قلوي (قادر على الارتباط مع ذرة هيدروجين)، لا لون له، يتمتع برائحة قوية نفاذة تسبب تهيج بعض أغشية الجسم كالعينين والبلعوم.
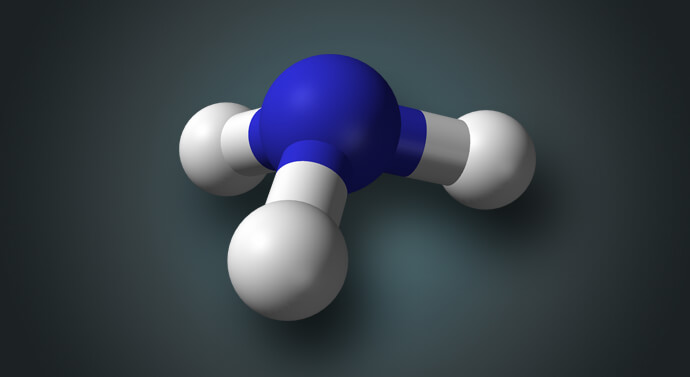
يتكون النشادر من ارتباط ذرة نيتروجين (N) مع ثلاثة ذرات هيدروجين (H)، حيث أن كل رابطة تشاركية من روابط النتروجين الثلاث ترتبط مع ذرة هيدروجين ذات الرابطة التشاركية الواحدة، بذلك يتشكل مركب غاز النشادر (NH3).(شرح الصورة؛ جزيء النشادر، النيتروجين باللون الأزرق والهيدروجين باللون الأبيض)
خواص الأمونيا (النشادر)
- رائحة قوية نفاذة تسبب تهيج في أعضاء جهاز التنفس والعيون، وله طعم حادّ.
- ذو قابلية شديدة للذوبان في الماء، تقلُّ هذه القابلية مع ارتفاع درجة الحرارة.
- أخف من الهواء (حوالي نصف الكتلة الحجمية للهواء).
- ينصهر عند الدرجة (-77.73 درجة مئوية) ويغلي عند الدرجة (-33.34).*
- يمتص درجة حرارة كبيرة عند تحوله من سائل إلى غاز، لذلك كان يستخدم في أجهزة التبريد.
- يملك ثابت تشرد (تأين) ضعيف (1.8×〖10〗^(-5))، لذلك فإن الأملاح التي يشكلها في تفاعلاته مع الأحماض تكون ضعيفة الحموضة.
- يمكن الكشف عنه في التفاعلات بسهولة، فهو يقوم بتحويل ورق عباد الشمس إلى اللون الأزرق.
- عند خفض درجة حرارة الغاز بشكل عام يتحول لسائل، وعند استمرار خفض درجة الحرارة يتحول لصلب بشكل مشابه للماء، فهو غاز في حالة بخار الماء، سائل في الحالة الطبيعية، صلب عند التبريد.
طرق تحضير غاز الأمونيا
تتم هذه الطريقة بمفاعلة مركب كربيد الكالسيوم (CaC2) الذي يتم سحقه ومن ثم تسخينه حتى درجة حرارة 1100 مئوية مع غاز النيتروجين وفق التفاعل التالي:
C_a C_2+N_2→C_a CN_2+C
حيث ينتج لدينا سياناميد الكالسيوم (CaCN2)، إضافةً للغرافيت (C) وهو أحد أشكال الكربون.
ثم نقوم بتسخين سياناميد الكالسيوم مع الماء تحت ضغط مرتفع جداً فيحدث التفاعل التالي:
C_a CN_2+3H_2 O→C_a CO_3+2NH_3
ناتجاً بذلك كربونات الكالسيوم (CaCo3)، إضافة لغاز النشادر أو الأمونيا.
تفاعل هابر:
يتم تحضير النشادر بعدة طرق أهمها:
طريقة السياناميد وهي طريقة ابتكرها الألماني "فريتس هابر" (Fritz Haber) عام 1913 وحصل على جائزة نوبل على اكتشافه عام 1918، تعتمد هذه الطريقة على التفاعل المباشر بين النتروجين والهيدروجين، لكن تحت ضغط مرتفع (300 ضغط جوي) ودرجة حرارة أيضاً مرتفعة (475 درجة مئوية) وبوجود مادة وسيطية (تساعد على حدوث التفاعل) مثل أكسيد الألمنيوم، حيث يمكن كتابة التفاعل على الشكل التالي:
N_2+3H_2→2NH_3
استخدامات الأمونيا استعمالات غاز النشادر (الأمونية)
للأمونيا العديد من الاستخدامات الصناعية والزراعية، ومن أهم استخداماته:
- استخدامه في التبريد والتكييف، ذلك بسبب كمية الحرارة الكبيرة التي يمتصها عند تحوله من سائل إلى غاز (372 سعرة حرارية) لكن في الوقت الحالي تم استبداله بغاز الفريون؛، بسبب سمية الأمونيا وتأثيرها على الصحة.
- يستخدم كوقود للآليات الكبيرة في المصانع شرط أن لا تحتوي الآلة على النحاس، حيث أن الأمونيا يسبب الصدأ للنحاس في حال اختلط مع الأوكسيجين.
- يُستخدم بشكل كبير في صناعة الأسمدة، وهذا السبب الأساسي الذي دفع فريتز هابر لاكتشاف طريقة جديدة لإنتاجه، حيث أن النشادر يُستخدم في صناعة 75% من الأسمدة.
- يستخدم بشكل واسع كمنظف للقطن والصوف وغيرهما؛ من البقع الصعبة.
- تتم أكسدة الأمونياك بكميات كبيرة لتحضير حمض الآزوت (HNO3) المسمى أيضاً بماء الفضة، الذي يدخل في صناعات هامة مثل صناعة المواد الطبية والمرايا العاكسة، إضافةً للمتفجرات بعد خلطه مع حمض الكبريتيك المركز.
مخاطر غاز النشادر (الأمونيا) على صحة الإنسان
كما ذكرنا سابقاً فإن الأمونيا يسبب تهيجات في بعض الأغشية في جسم الانسان، إلا أن هذا التأثير خارجي فقط، حيث أن جسم الإنسان أيضاً يقوم بإنتاج الأمونيا وذلك بعد هدم البروتينات لاستهلاكها في الجسم، ومن ثم يقوم الجسم بتحويل الأمونيا إلى مادة أقل سمّية وهي اليوريا في الكليتين.
لكن قد يحصل اضطراب في عمل الكلى، مما يؤدي إلى زيادة نسبة الأمونيا في الدم، وهذه الحالة خطرة جداً وقد تؤدي إلى التهابات في الدماغ والموت.
ختاماً.. رغم مخاطر الأمونيا على جسم الانسان، واستعماله في الحرب العالمية الأولى على يد هابر ذاته كسلاح كيميائي، إلا أن له العديد من الاستخدامات الهامة وبالأخص في مجال الزراعة وصناعة الأسمدة.